Основы плазмо — химических преобразований
До настоящего момента мы рассматривали атомы и молекулы в воздухе, их возбуждение, диссоциацию, ионизацию и возбуждение не акцентируя внимание на химических преобразованиях, которые происходят с этими частицами. Теперь мы рассмотрим процессы химических преобразований, которые происходят с различными атомами, молекулами, активными радикалами и ионами, которые возникают в процессе формирования и развития электрического разряда в воздухе.
Все физико-химические процессы происходящие в плазме газового разряда можно разделить на три временных интервала:
1. Δt ≈ 10-15 с — на этом интервале времени завершаются процессы возбуждения атомов и молекул электронным или фотонным ударом;
2. Δt ≈ 10-13 с — на этом интервале времени завершаются процессы ионизации и диссоциации атомов и молекул;
3. Этот интервал времени имеет переменную продолжительность вплоть до Δt ≈ 10-3 с в зависимости от состава газа, температуры и давления — это стадия химических процессов и реакций.
Понятие кинетики химических реакций
Химическая кинетика — это учение механизмов и закономерностей протекания во времени химических процессов. Под химической реакцией понимается процесс превращения одного или нескольких веществ (реагентов) в вещества (продукты реакции), отличающиеся от исходных по химическому или изотопному составу, по строению молекул или заряду.
В большинстве случаев химический процесс происходит не путем прямого превращения исходных веществ в продукты реакции, а состоит из нескольких стадий. Каждую из этих стадий можно рассматривать как самостоятельную химическую реакцию со своими исходными веществами и продуктами. Такие реакции называются элементарными.
Важнейшими характеристиками химической реакции являются степень превращения (т.е. отношение количества вещества, вступившего в реакцию, к его исходному количеству) и скорость реакции (т.е. количество вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема):
ω = ±dN/dt
где N — число молей (или молекул) в единице объема.
Поясним сказанное на примере реакции:
a×A + b×B → c×C + d×D, (1)
где A, B, C, D — реагенты и продукты реакции, а числа a, b, c, d — стехиометрические коэффициенты, которые определяют количественные соотношения, в которых вещества вступают в реакцию.
Например:
2NaOH + H2SO4 → Na2SO4 + 2H2O
В этой реакции: NaOH и H2SO4 — реагенты; Na2SO4 и H2O — продукты реакции. Стехиометрические коэффициенты a = 2, b = 1, c = 1, d = 2 показывают, что если в реакцию вступят два моля NaOH и один моль H2SO4, то эти вещества прореагируют полностью и образуется один моль Na2SO4 и два моля H2O.
Скорость изменения плотности каждого реагента или продукта реакции в ходе такой реакции будет связана со скоростью реакции следующим соотношением:
ω = — 1/a dNa/dt = -1/b dNB/dt = 1/c dNc/dt = 1/d dND/dt
Для элементарных химических реакций действует следующее обобщенное правило химической кинетики (закон действующих масс): скорость элементарной химической реакции в каждый момент времени пропорциональна произведению текущих концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Для реакции (12.1) выражение для скорости реакции будет иметь вид:
ω = k(NA)a(NB)b
где k — константа скорости реакции, независимая от плотности реагентов. Ее еще называют удельной скоростью реакции, поскольку при концентрации каждого из реагирующих веществ, равной единице, она равна фактически скорости реакции.
Понятие константы скорости реакции широко используется в плазмо-химических технологиях при оценке интенсивности и роли происходящих в них химических реакций.
При протекании реакции по стадиям производятся и расходуются так называемые промежуточные вещества, которые обычно представляют из себя химически активные частицы — ионы, возбужденные молекулы, свободные радикалы. Свободные радикалы — это молекулы в особом состоянии, когда происходит разрыв связи между атомами, и эти молекулы приобретают, таким образом, свободные валентные связи. В результате свободные радикалы получают некоторую избыточную потенциальную энергию по сравнению с исходными молекулами. Как следствие это приводит к увеличению химической активности. Свободные радикалы существуют очень короткое время (~10-3).
Свободные радикалы образуются, например, при взаимодействии молекул с электронами в электрическом поле:
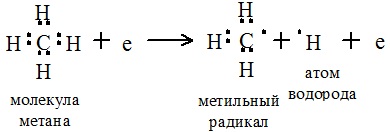
Ионы, свободные атомы и радикалы имеют неспаренные электроны на внешней электронной оболочке и в связи с их высокой химической активностью их называют химически активными частицами. Возбужденные молекулы и атомы служат передатчиками энергии от электронов плазмы к активным (ионизируемым или диссоциируемым) атомам или молекулам.
Сложные реакции состоят из простых реакций (стадий), которые можно в свою очередь классифицировать по нескольким группам:
1. Необратимые реакции вида: A → B. Химические реакции называются необратимыми, если вещества практически полностью превращаются в конечный продукт. Важнейшим условием необратимости химических реакций является выделение одного из продуктов реакции в виде осадка, образование газообразного продукта реакции либо образование малодиссоциированного продукта реакции (например, воды).
2. Двусторонние или обратимые реакции вида: А ↔ В. Большая часть химических реакций обратима. Обратимыми называются такие химические реакции, которые протекают при данной температуре в двух противоположных направлениях — прямом и обратном.
3. Параллельные реакции вида: A → B, A → C, A → L;
4. Последовательные реакции вида: A → B, B → C, C → L.
Сам процесс или акт химического превращения заключается в том, что при сближении двух или нескольких частиц происходит постепенная перестройка связей между атомами. При этом одни связи разрываются, а другие образуются. В результате из исходных веществ образуются продукты реакции.
Состояние, в котором одни связи уже растянулись, но еще не разорвались, а новые только образуются, называется переходным состоянием. Совокупность частиц, находящихся в переходном состоянии образует, так называемый, активированный комплекс, который в переходном состоянии находится на вершине потенциального барьера.
В качестве примера рассмотрим ход реакции H2+I2=2HI, которая, как показали современные исследования, является сложной реакцией, состоящей из трех элементарных реакций
I2 → 2I*; I* + H2 → HI + H*; 2H* → H2
Рассмотрим более подробно вторую элементарную реакцию. В процессе протекания этой реакции сначала радикал йода I* сближается с молекулой водорода, далее связь между атомами водорода растягивается и образуется активный комплекс, состоящий из атома йода и двух атомов водорода. И, наконец, формируется связь между атомом йода и атомом водорода и образуется несвязанный радикал водорода. Схематично путь этой реакции изображен на рис. 1.
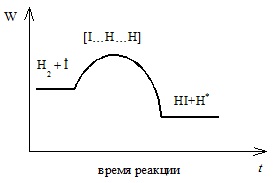
Рис.1. Схематичное изображение химической реакции на шкале потенциальной энергии
Примерами быстро протекающих химических реакций могут служить реакции типа взрыва, а медленно протекающих реакций — реакции ферментации виноградного сока с получением виноградного вина, которые протекают от нескольких месяцев до нескольких лет.
На практике скорость химической реакции можно определить графически из зависимости массы продукта химической реакции в единице объема от времени протекания реакции (рис. 2).
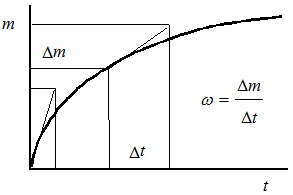
Рис.2. Зависимость массы продукта реакции от времени реакции и определение скорости химической реакции